Skandij, s simbolom elementa Sc in atomskim številom 21, je lahko topen v vodi, lahko reagira z vročo vodo in zlahka potemni na zraku. Njegova glavna valenca je +3. Pogosto se meša z gadolinijem, erbijem in drugimi elementi, z nizkim izkoristkom in vsebnostjo približno 0,0005 % v skorji. Skandij se pogosto uporablja za izdelavo posebnega stekla in lahkih visokotemperaturnih zlitin.
Trenutno so dokazane svetovne rezerve skandija le 2 milijona ton, od tega 90–95 % v boksitnih, fosforitnih in železovo-titanovih rudah, majhen del pa v uranovih, torijevih, volframovih in redkozemeljskih rudah, ki so večinoma razširjene v Rusiji, na Kitajskem, v Tadžikistanu, na Madagaskarju, Norveškem in v drugih državah. Kitajska je zelo bogata z viri skandija, z ogromnimi mineralnimi rezervami, povezanimi s skandijem. Po nepopolnih statističnih podatkih so rezerve skandija na Kitajskem približno 600.000 ton, ki so v nahajališčih boksita in fosforita, nahajališčih volframa v porfirnih in kremenčevih žilah na jugu Kitajske, nahajališčih redkih zemelj na jugu Kitajske, nahajališčih železove rude Bayan Obo v Notranji Mongoliji in nahajališčih vanadijevega titanovega magnetita Panzhihua v Sečuanu.
Zaradi pomanjkanja skandija je tudi cena skandija zelo visoka, na vrhuncu pa se je cena skandija napihnila na 10-kratnik cene zlata. Čeprav je cena skandija padla, je še vedno štirikratnik cene zlata!
Odkrivanje zgodovine
Leta 1869 je Mendelejev opazil vrzel v atomski masi med kalcijem (40) in titanom (48) ter napovedal, da obstaja tudi neodkrit element z vmesno atomsko maso. Napovedal je, da je njegov oksid X ₂ O Å. Skandij je leta 1879 odkril Lars Frederik Nilson z Univerze v Uppsali na Švedskem. Izkopaval ga je iz rudnika črnega redkega zlata, kompleksne rude, ki vsebuje 8 vrst kovinskih oksidov. Izkopaval jeErbijev(III) oksidiz črne redke zlate rude in pridobljeneIterbijev(III) oksidiz tega oksida nastane še en oksid lažjega elementa, katerega spekter kaže, da gre za neznano kovino. To je kovina, ki jo je napovedal Mendelejev, katerega oksid jeSc₂O₃Sama kovina skandij je bila proizvedena izSkandijev kloridz elektrolitskim taljenjem leta 1937.
Mendelejev
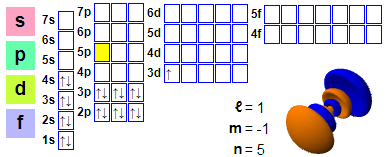
Elektronska konfiguracija
Elektronska konfiguracija: 1s2 2s2 2p6 3s2 3p6 4s2 3d1
Skandij je mehka, srebrno bela prehodna kovina s tališčem pri 1541 ℃ in vreliščem pri 2831 ℃.
Po odkritju skandija njegova uporaba precej časa ni bila dokazana zaradi težavnosti pri proizvodnji. Z vse večjim izboljšanjem metod ločevanja redkozemeljskih elementov je zdaj na voljo zrel postopek za čiščenje skandijevih spojin. Ker je skandij manj alkalen kot itrij in lantanid, je hidroksid najšibkejši, zato se mešani mineral redkozemeljskih elementov, ki vsebuje skandij, loči od redkozemeljskega elementa z metodo "stopenjskega obarjanja", kjer se skandijev(III) hidroksid po prenosu v raztopino obdela z amoniakom. Druga metoda je ločevanje skandijevega nitrata s polarno razgradnjo nitrata. Ker se skandijev nitrat najlažje razgradi, ga je mogoče ločiti. Poleg tega je pomemben vir skandija tudi celovito pridobivanje spremljajočega skandija iz uranovih, torijevih, volframovih, kositrovih in drugih mineralnih nahajališč.
Ko dobimo čisto skandijevo spojino, jo pretvorimo v ScCl Å in skupaj s KCl in LiCl. Staljeni cink se uporablja kot katoda za elektrolizo, pri čemer se skandij obori na cinkovi elektrodi. Nato cink uparimo, da dobimo kovinski skandij. To je lahka srebrno-bela kovina z zelo aktivnimi kemičnimi lastnostmi, ki lahko reagira z vročo vodo in ustvari vodikov plin. Kovinski skandij, ki ga vidite na sliki, je torej zaprt v steklenici in zaščiten z argonom, sicer bo skandij hitro tvoril temno rumeno ali sivo oksidno plast in izgubil svoj sijoč kovinski sijaj.
Aplikacije
Svetlobna industrija
Uporaba skandija je skoncentrirana v zelo svetlih smereh in ni pretiravanje, če ga imenujemo Sin svetlobe. Prvo čarobno orožje skandija se imenuje skandijeva natrijeva svetilka, ki jo je mogoče uporabiti za osvetlitev tisočev gospodinjstev. To je kovinsko-halogenidna električna svetilka: žarnica je napolnjena z natrijevim jodidom in skandijevim trijodidom, hkrati pa se dodata skandijeva in natrijeva folija. Med visokonapetostnim praznjenjem skandijevi ioni oziroma natrijevi ioni oddajajo svetlobo svojih značilnih valovnih dolžin emisije. Spektralne črte natrija so 589,0 in 589,6 nm, dve znani rumeni svetlobi, medtem ko so spektralne črte skandija 361,3~424,7 nm, vrsta emisij bližnje ultravijolične in modre svetlobe. Ker se medsebojno dopolnjujejo, je celotna barva svetlobe bela svetloba. Prav zato, ker imajo skandijeve natrijeve sijalke značilnosti visoke svetlobne učinkovitosti, dobre barve svetlobe, varčevanja z energijo, dolge življenjske dobe in močne sposobnosti preprečevanja megle, se lahko pogosto uporabljajo za televizijske kamere, trge, športna prizorišča in cestno razsvetljavo ter so znane kot svetlobni viri tretje generacije. Na Kitajskem se ta vrsta sijalke postopoma uveljavlja kot nova tehnologija, medtem ko se je v nekaterih razvitih državah ta vrsta sijalke pogosto uporabljala že v zgodnjih osemdesetih letih prejšnjega stoletja.
Drugo čarobno orožje skandija so sončne fotonapetostne celice, ki lahko zbirajo svetlobo, razpršeno po tleh, in jo pretvorijo v elektriko za pogon človeške družbe. Skandij je najboljša pregradna kovina v kovinskih izolatorjih, polprevodniških silicijevih sončnih celicah in sončnih celicah.
Njegovo tretje magično orožje se imenuje vir γ A žarkov. To magično orožje lahko samo po sebi močno sveti, vendar te vrste svetlobe ni mogoče zaznati s prostim očesom, saj gre za visokoenergijski fotonski tok. Običajno iz mineralov pridobivamo 45Sc, ki je edini naravni izotop skandija. Vsako jedro 45Sc vsebuje 21 protonov in 24 nevtronov. 46Sc, umetni radioaktivni izotop, se lahko uporablja kot vir γ sevanja ali sledilni atomi, ki se lahko uporabljajo tudi za radioterapijo malignih tumorjev. Obstajajo tudi aplikacije, kot je itrijev galijev skandijev granatni laser.Skandijev fluoridSteklena infrardeča optična vlakna in s skandijem prevlečena katodna cev na televiziji. Zdi se, da se skandij rodi s svetlostjo.
Industrija zlitin
Skandij v svoji elementarni obliki se pogosto uporablja za dopiranje aluminijevih zlitin. Že nekaj tisočink skandija dodamo aluminiju, da se tvori nova faza Al3Sc, ki igra vlogo metamorfoze v aluminijevi zlitini in znatno spremeni strukturo in lastnosti zlitine. Dodatek 0,2 % do 0,4 % Sc (kar je zelo podobno deležu dodajanja soli v doma ocvrto zelenjavo, potrebna je le majhna količina) lahko poveča temperaturo rekristalizacije zlitine za 150–200 ℃ in znatno izboljša visokotemperaturno trdnost, strukturno stabilnost, varilne lastnosti in odpornost proti koroziji. Prav tako se lahko izognemo pojavu krhkosti, ki se zlahka pojavi med dolgotrajnim delom pri visokih temperaturah. Visoko trdne in visoko žilave aluminijeve zlitine, nove visoko trdne, korozijsko odporne varljive aluminijeve zlitine, nove visokotemperaturne aluminijeve zlitine, visoko trdne, proti nevtronskemu obsevanju odporne aluminijeve zlitine itd. imajo zelo privlačne razvojne možnosti v vesoljski industriji, letalstvu, ladjah, jedrskih reaktorjih, lahkih vozilih in hitrih vlakih.
Skandij je tudi odličen modifikator za železo, majhna količina skandija pa lahko znatno izboljša trdnost in trdoto litega železa. Poleg tega se skandij lahko uporablja tudi kot dodatek za visokotemperaturne volframove in kromove zlitine. Seveda ima skandij poleg izdelave poročnih oblačil za druge visoko tališče in gostoto, podobno aluminiju, in se uporablja tudi v lahkih zlitinah z visokim tališčem, kot sta skandijeva titanova zlitina in skandijeva magnezijeva zlitina. Vendar se zaradi visoke cene običajno uporablja le v vrhunskih predelovalnih panogah, kot so vesoljska plovila in rakete.
Keramični material
Skandij, ena sama snov, se običajno uporablja v zlitinah, njegovi oksidi pa igrajo podobno pomembno vlogo tudi v keramičnih materialih. Tetragonalni cirkonijev keramični material, ki se lahko uporablja kot elektrodni material za gorivne celice s trdnim oksidom, ima edinstveno lastnost, da se prevodnost tega elektrolita povečuje z naraščajočo temperaturo in koncentracijo kisika v okolju. Vendar pa kristalna struktura tega keramičnega materiala sama po sebi ne more stabilno obstajati in nima industrijske vrednosti; potrebno je dodati nekaj snovi, ki lahko to strukturo fiksirajo, da se ohranijo njene prvotne lastnosti. Dodatek 6~10% skandijevega oksida je podoben betonski strukturi, tako da se cirkonijev dioksid lahko stabilizira na kvadratni mreži.
Obstajajo tudi inženirski keramični materiali, kot je visokotrdni in visokotemperaturno odporni silicijev nitrid, kot zgoščevalci in stabilizatorji.
Kot zgoščevalec,Skandijev oksidNa robu drobnih delcev lahko tvori ognjevzdržno fazo Sc2Si2O7, s čimer zmanjša visokotemperaturno deformacijo inženirske keramike. V primerjavi z drugimi oksidi lahko bolje izboljša visokotemperaturne mehanske lastnosti silicijevega nitrida.
Katalitična kemija
V kemijskem inženirstvu se skandij pogosto uporablja kot katalizator, medtem ko se Sc2O3 lahko uporablja za dehidracijo in deoksidacijo etanola ali izopropanola, razgradnjo ocetne kisline in proizvodnjo etilena iz CO in H2. Katalizator Pt-Al, ki vsebuje Sc2O3, je pomemben tudi za hidrogeniranje težkih olj in procese čiščenja ter rafiniranja v petrokemični industriji. V reakcijah katalitskega krekinga, kot je kumen, je aktivnost zeolitnega katalizatorja Sc-Y 1000-krat večja kot pri aluminijevem silikatu; v primerjavi z nekaterimi tradicionalnimi katalizatorji so možnosti razvoja skandijevih katalizatorjev zelo svetle.
Jedrska energetska industrija
Z dodajanjem majhne količine Sc2O3 k UO2 v visokotemperaturnem jedrskem gorivu reaktorja se lahko izognemo transformaciji kristalne mreže, povečanju volumna in razpokanju, ki jih povzroča pretvorba UO2 v U3O8.
Gorivna celica
Podobno bo dodajanje od 2,5 % do 25 % skandija nikelj-alkalnim baterijam podaljšalo njihovo življenjsko dobo.
Kmetijska vzreja
V kmetijstvu se lahko semena, kot so koruza, pesa, grah, pšenica in sončnice, obdelajo s skandijevim sulfatom (koncentracija je običajno 10⁻³ do 10⁻⁶ mol/L, različne rastline imajo različne vrednosti), dejanski učinek spodbujanja kalitve pa je bil dosežen. Po 8 urah se je suha teža korenin in popkov povečala za 37 % oziroma 78 % v primerjavi s sadikami, vendar mehanizem še vedno preučujemo.
Od Nielsenove pozornosti do dolga podatkov o atomski masi do danes je skandij v človeškem očesu šele sto ali dvajset let, a je skoraj sto let sedel na klopi. Šele bujen razvoj znanosti o materialih konec prejšnjega stoletja mu je vnesel vitalnost. Danes so redkozemeljski elementi, vključno s skandijem, postali vroče zvezde v znanosti o materialih, ki igrajo nenehno spreminjajoče se vloge v tisočih sistemih, vsak dan prinašajo več udobja v naša življenja in ustvarjajo ekonomsko vrednost, ki jo je še težje izmeriti.
Čas objave: 29. junij 2023