Cerij je nesporni "veliki brat" v veliki družini redkozemeljskih elementov. Prvič, skupna količina redkozemeljskih elementov v skorji je 238 ppm, pri čemer je cerij pri 68 ppm, kar predstavlja 28 % celotne sestave redkozemeljskih elementov in je na prvem mestu; drugič, cerij je drugi redkozemeljski element, odkrit devet let po odkritju itrija (1794). Njegova uporaba je zelo obsežna, "cerij" pa je neustavljiv.
Odkritje cerija

Carl Auer von Welsbach
Cerij so leta 1803 odkrili in poimenovali Nemec Kloppers, švedski kemik Jöns Jakob Berzelius in švedski mineralog Wilhelm Hisinger. Imenuje se cerij, njegova ruda pa cerit v spomin na Ceres, asteroid, odkrit leta 1801. Pravzaprav je ta vrsta cerijevega silikata hidrirana sol, ki vsebuje od 66 % do 70 % cerija, preostanek pa so spojine kalcija, železa in ...itrij.
Cerij je bil prvi primer uporabe plinskega kamina, ki ga je izumil avstrijski kemik Carl Auer von Welsbach. Leta 1885 je poskusil z mešanico magnezija, lantana in itrijevega oksida, vendar so te mešanice neuspešno oddajale zeleno luč.
Leta 1891 je ugotovil, da čisti torijev oksid proizvaja boljšo svetlobo, čeprav je modre barve, in ga je zmešal s cerijevim(IV) oksidom, da je ustvaril svetlo belo svetlobo. Poleg tega se cerijev(IV) oksid lahko uporablja tudi kot katalizator za zgorevanje torijevega oksida.
cerij kovina

★ Cerij je duktilna in mehka srebrno bela kovina z aktivnimi lastnostmi. Ko je izpostavljen zraku, oksidira in tvori rji podobno luščečo se oksidno plast. Pri segrevanju gori in hitro reagira z vodo. Vzorec kovinskega cerija velikosti centimetra popolnoma korodira v približno enem letu. Izogibajte se stiku z zrakom, močnimi oksidanti, močnimi kislinami in halogeni.
★ Cerij se nahaja predvsem v monazitu in bastnaezitu, pa tudi v cepitvenih produktih urana, torija in plutonija. Škodljiv za okolje, zato je treba posebno pozornost nameniti onesnaževanju vodnih teles.
★ Cerij je 26. najpogostejši element, saj predstavlja 68 ppm Zemljine skorje, takoj za bakrom (68 ppm). Cerija je več kot navadnih kovin, kot sta svinec (13 ppm) in kositer (2,1 ppm).
Cerijeva elektronska konfiguracija
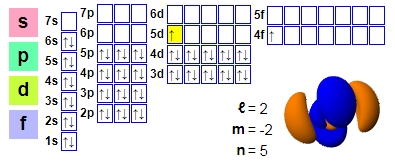
Elektronski dogovori:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s2 4f1 5d1
★ Cerij se nahaja za lantanom in ima 4f elektrone, ki se začnejo pri ceriju, zaradi česar lahko sodeluje v kemijskih reakcijah. Vendar pa je 5d orbitala cerija zasedena in ta učinek v ceriju ni dovolj močan.
★ Večina lantanidov lahko kot valentne elektrone uporabi le tri elektrone, z izjemo cerija, ki ima spremenljivo elektronsko strukturo. Energija 4f elektronov je skoraj enaka energiji zunanjih 5d in 6s elektronov, delokaliziranih v kovinskem stanju, in za spremembo relativne zasedenosti teh elektronskih energijskih nivojev je potrebna le majhna količina energije, kar ima za posledico dvojno valenco +3 in +4. Normalno stanje je valenca +3, kar kaže na valenco +4 v anaerobni vodi.
Uporaba cerija

★ Lahko se uporablja kot dodatek za zlitine in za proizvodnjo cerijevih soli itd.
★ Uporablja se lahko kot dodatek za steklo za absorpcijo ultravijoličnih in infrardečih žarkov in se pogosto uporablja v avtomobilskem steklu.
★ Uporablja se lahko kot odličen material za varstvo okolja, trenutno pa je najbolj reprezentativen katalizator za čiščenje izpušnih plinov avtomobilov, ki učinkovito preprečuje izpust velike količine izpušnih plinov avtomobilov v zrak.
★ Svetlobaredki zemeljski elementiv glavnem sestavljeni iz cerija kot regulatorjev rasti rastlin, ki lahko izboljšajo kakovost pridelka, povečajo pridelek in povečajo odpornost pridelka na stres.
★ Cerijev sulfid lahko v pigmentih nadomesti kovine, kot sta svinec in kadmij, ki so škodljive za okolje in ljudi, lahko obarva plastiko in se lahko uporablja tudi v industriji premazov in črnil.
★Cerijev(IV) oksidse lahko uporablja kot polirna pasta, na primer pri kemično-mehanskem poliranju (CMP).
★ Cerij se lahko uporablja tudi kot material za shranjevanje vodika, termoelektrični materiali, cerijeve volframove elektrode, keramični kondenzatorji, piezoelektrična keramika, abrazivi iz cerijevega silicijevega karbida, surovine za gorivne celice, katalizatorji za bencin, trajni magnetni materiali, medicinski materiali, različna legirana jekla in neželezne kovine.
Čas objave: 3. julij 2023